Surtout, les interactions entre ces entités hématologiques et les nanomatériaux de graphène influenceront l'efficacité globale de leurs applications biomédicales. En tant que tel, une compréhension globale de l'hémotoxicité des nanomatériaux de graphène est d'une importance cruciale. Cette revue présente une élucidation à jour de l'hémotoxicité des nanomatériaux de graphène à travers leurs interactions avec les protéines sanguines et les cellules, et offre quelques perspectives sur les défis actuels, les opportunités et le développement futur de ce domaine important.
INTRODUCTION
L'isolement expérimental réussi du graphène bidimensionnel (2D) monocouche en 2004 a suscité un intérêt croissant pour cette classe de nanomatériaux à base de carbone. 1 Avec leur caractéristique structurelle 2D unique et leurs propriétés physico-chimiques exceptionnelles, 2 - 9 notamment une conductivité électrique exceptionnelle, une conductivité thermique exceptionnelle, une excellente résistance mécanique, une chimie de surface polyvalente et une biocompatibilité élevée, le graphène et ses dérivés ont été activement explorés pour une large gamme de potentiel applications, allant de la nanoélectronique et de l'énergie à la nanobiotechnologie et à la biomédecine. 10 – 15 Spécifiquement pour les applications biologiques et biomédicales, telles que la biodétection, la bioimagerie, l'administration de médicaments, l'ingénierie tissulaire et la médecine régénérative, le graphène et ses dérivés, en particulier l'oxyde de graphène (GO) et l'oxyde de graphène réduit (rGO), se sont avérés très prometteurs. 16 – 24
Alors que la recherche active et les activités scientifiques ont été consacrées à découvrir des propriétés physico-chimiques plus inconnues et des bioapplications potentielles des nanomatériaux de graphène, des efforts parallèles ont été intensifiés récemment pour mieux comprendre leurs effets biologiques globaux, en particulier leur biocompatibilité et leur profil nanotoxicologique, à travers leurs interactions avec diverses fractions biologiques. Bien que les informations sur la nanotoxicité in vitro et in vivo des nanomatériaux de graphène aient été de plus en plus publiées ces dernières années, 25 – 33 une image complète sur la biocompatibilité des nanomatériaux de graphène n'a pas été établie. Comme les nanomatériaux de graphène devraient jouer un rôle important dans la mise en place de technologies avancées en nanomédecine et en bionanotechnologie, une compréhension globale de la biocompatibilité de ces nanomatériaux manufacturés, en particulier de leur hémocompatibilité avec divers constituants du sang, est nécessaire.
Le sang est l'un des fluides biologiques les plus importants dans les systèmes physiologiques. Avec un volume d'environ 5 L chez un adulte humain, il constitue environ 7 à 8 % du poids corporel total. Constituant, le sang comprend des cellules sanguines [c'est-à-dire des globules rouges (GR) ou des érythrocytes, des globules blancs (WBC) ou des leucocytes et des plaquettes] (45 %) en suspension dans du plasma riche en protéines (55 %). De plus, le plasma sanguin est fondamentalement un corps aqueux constitué d'environ 92 % d'eau et 8 % de protéines plasmatiques. Chacun de ces composants sanguins possède des fonctions biologiques distinctes et spécifiques. Par exemple, les globules rouges maintiennent la régulation des transports d'oxygène et de nutriments vers différents tissus et organes, les globules blancs facilitent la défense et la lutte contre les infections et les corps étrangers, les plaquettes sont responsables de la régulation du processus de coagulation sanguine,le plasma sanguin agit comme le principal moyen d'élimination de divers produits métaboliques et excréteurs.
En général, la plupart des bioapplications in vivo des nanomatériaux de graphène nécessitent leur administration dans le système circulatoire sanguin. De ce fait, les nanomatériaux de graphène seront inévitablement exposés aux biomolécules et aux cellules environnantes du système circulatoire, notamment aux protéines plasmatiques et aux cellules sanguines. Fait intéressant, les interactions moléculaires et cellulaires des nanomatériaux de graphène avec ces fractions hématologiques sont cruciales car la réponse hématologique envers les nanomatériaux de graphène et l'efficacité globale des bioapplications à base de nanomatériaux de graphène dépendront de ces interactions nano-bio. En tant que tel,une compréhension approfondie de l'hémocompatibilité et du profil hémotoxicologique des nanomatériaux de graphène est essentielle pour leur développement et leur optimisation pour des bioapplications spécifiques ainsi que pour leur traduction efficace en utilité pratique et clinique.
Motivée par cela, cette revue présente un large aperçu des avancées récentes sur l'hémocompatibilité et l'hémotoxicité des nanomatériaux de graphène à travers leurs interactions avec les protéines sanguines et les cellules (Fig. 1 ). Pour commencer, diverses propriétés physico-chimiques des nanomatériaux de graphène cruciales pour affecter leur hémocompatibilité et leur hémotoxicité sont discutées. Par la suite, les interactions nano-bio des nanomatériaux de graphène avec différentes protéines sériques et cellules sanguines sont mises en évidence. Cette revue se termine ensuite par un résumé et offre quelques perspectives sur les défis actuels, les opportunités et le développement futur de ce domaine crucial.
II. PARAMÈTRES PHYSICOCHIMIQUES INFLUANT SUR L'HÉMOTOXICITÉ DES NANOMATÉRIAUX DE GRAPHÈNE
Comme les premiers 2D nanomatériaux à isoler expérimentalement, 1 graphène et ses dérivés possèdent de nombreuses propriétés physico - chimiques exceptionnelles, 2 - 9 , comme une excellente conductivité électrique, résistance mécanique robuste, polyvalent chimie de surface, une excellente biocompatibilité et cytotoxicité minimale. En fait, les caractéristiques uniques et la polyvalence des nanomatériaux de graphène ont motivé leurs exploitations actives pour une grande variété d'applications biologiques et biomédicales. 16 – 24 Néanmoins, malgré le potentiel important qu'ils ont pour faire avancer les domaines de la nanobiotechnologie et de la nanomédecine, plusieurs préoccupations existent et nécessitent des investigations approfondies avant que les applications de validation de principe puissent être encore améliorées et traduites.
L'une des préoccupations les plus critiques et croissantes concerne la biocompatibilité et la nanotoxicité du graphène et de ses nanomatériaux associés. 34 , 35 En fait, la nanotoxicité des nanomatériaux de graphène a été de plus en plus évaluée ces dernières années. 25 – 33 Par exemple, les évaluations in vitro des effets cytotoxiques potentiels des nanomatériaux de graphène ont été activement menées sur différentes lignées cellulaires humaines, 25 , 36 – 41 tels que les fibroblastes humains, les cellules endothéliales de la veine ombilicale humaine (HUVEC), les cellules pulmonaires humaines normales (BEAS-2B), les cellules cancéreuses pulmonaires humaines (A549), les cellules d'hépatocarcinome humain (HepG2), les cellules HeLa et les cellules cancéreuses du sein humaines MCF-7 . Une majorité de ces études ont démontré la cytotoxicité dépendante du temps et de la dose des nanomatériaux de graphène. De plus, de nombreuses études expérimentales et théoriques in vitro ont attribué la cytotoxicité du graphène et de son dérivé oxygéné GO sur les cellules et les bactéries de mammifères à la pénétration de la membrane cellulaire, suivie de l'extraction de molécules de phospholipides de la bicouche lipidique. 42 , 43
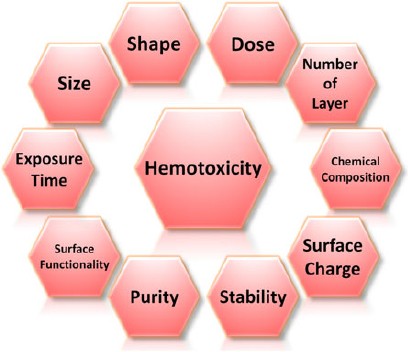
Un petit nombre d'études in vivo ont également démontré précédemment qu'après administration intraveineuse à des rats ou des souris, la GO s'accumulait dans les poumons pendant une période prolongée, présentait une toxicité pulmonaire dose-dépendante et provoquait la mort par granulome pulmonaire. Cela montre que, bien que les nanomatériaux de graphène possèdent un potentiel énorme pour les applications biologiques, ils peuvent également induire une toxicité indésirable dans certaines conditions. Ainsi, avant de progresser dans la réalisation de leurs bioapplications possibles, une compréhension approfondie de leur profil nanotoxicologique, en particulier de leur hémotoxicité, est nécessaire. Néanmoins, en raison de la nouveauté de cette famille de nanomatériaux, à ce jour, des études limitées ont été réalisées pour élucider l'hémocompatibilité des nanomatériaux de graphène. Les informations de sécurité sur les nanomatériaux de graphène sont doncconsidérablement rares et leur profil hémotoxicologique est encore loin d'être établi. Il est également important de noter qu'il peut ne pas être possible de déduire l'hémocompatibilité et l'hémotoxicité des nanomatériaux de graphène directement à partir de leur homologue en graphite en vrac. En effet, les interactions entre les nanomatériaux de graphène et les fractions biologiques sont distinctes et significativement influencées par de nombreuses caractéristiques physico-chimiques des nanomatériaux. Ceux-ci incluent la taille latérale, la forme, la dose, le temps d'exposition, le nombre de couches, la composition chimique, la charge de surface, la stabilité, la pureté et la fonctionnalité de surface des nanomatériaux de graphène (Fig.Il est également important de noter qu'il peut ne pas être possible de déduire l'hémocompatibilité et l'hémotoxicité des nanomatériaux de graphène directement à partir de leur homologue en graphite en vrac. En effet, les interactions entre les nanomatériaux de graphène et les fractions biologiques sont distinctes et significativement influencées par de nombreuses caractéristiques physico-chimiques des nanomatériaux. Ceux-ci incluent la taille latérale, la forme, la dose, le temps d'exposition, le nombre de couches, la composition chimique, la charge de surface, la stabilité, la pureté et la fonctionnalité de surface des nanomatériaux de graphène (Fig.Il est également important de noter qu'il peut ne pas être possible de déduire l'hémocompatibilité et l'hémotoxicité des nanomatériaux de graphène directement à partir de leur homologue en graphite en vrac. En effet, les interactions entre les nanomatériaux de graphène et les fractions biologiques sont distinctes et significativement influencées par de nombreuses caractéristiques physico-chimiques des nanomatériaux. Ceux-ci incluent la taille latérale, la forme, la dose, le temps d'exposition, le nombre de couches, la composition chimique, la charge de surface, la stabilité, la pureté et la fonctionnalité de surface des nanomatériaux de graphène (Fig.nombre de couches, composition chimique, charge de surface, stabilité, pureté et fonctionnalité de surface des nanomatériaux de graphène (Fig.nombre de couches, composition chimique, charge de surface, stabilité, pureté et fonctionnalité de surface des nanomatériaux de graphène (Fig.2 ).
Paramètres physico-chimiques influençant l'hémotoxicité des nanomatériaux de graphène. Ces paramètres incluent la taille, la forme, la dose, le nombre de couches, la composition chimique, la charge de surface, la stabilité, la pureté et la fonctionnalité de surface des nanomatériaux de graphène ainsi que le temps pendant lequel les entités biologiques sont exposées à ces nanomatériaux.
En effet, ces paramètres physico-chimiques des nanomatériaux de graphène ont été identifiés comme l'un des principaux éléments conduisant à l'apparition de nombreux mécanismes moléculaires et cellulaires déclenchant leur toxicité sanguine. Curieusement, les caractéristiques physico-chimiques des nanomatériaux de graphène sont fortement interdépendantes, et certaines propriétés peuvent être ajustées via la manipulation d'autres paramètres. Par exemple, il a été rapporté que les modifications chimiques des nanomatériaux de graphène pour les doter de différentes fonctionnalités de surface font varier leur charge de surface, leur stabilité et leur pureté dans une certaine mesure. À ce titre, les caractéristiques physico-chimiques des nanomatériaux de graphène jouent un rôle actif dans l'orientation de leur hémocompatibilité et de leur hémotoxicité.
III. INTERACTIONS DES NANOMATÉRIAUX DE GRAPHÈNE AVEC DES BIOMOLÉCULES SÉRIQUES ET DES PROTÉINES SANGUINES
L'utilisation efficace des nanomatériaux de graphène pour une variété d'applications biologiques et biomédicales nécessite une compréhension approfondie de leur hémocompatibilité et de leur profil hémotoxicologique. L'utilisation de nanomatériaux de graphène pour la majorité des applications biomédicales in vivo, notamment par voie intraveineuse, intramusculaire ou intrapéritonéale dans des organismes vivants, les obligera inévitablement à pénétrer dans le système circulatoire sanguin. En conséquence, ces nanomatériaux seront exposés à des fluides biologiques, y compris le sérum et le plasma, et interagiront immédiatement avec divers composants hématologiques et vasculaires. En fait, en entrant dans le microenvironnement de la circulation sanguine, un grand nombre de biomolécules sériques et de protéines plasmatiques interagiront avec la surface du nanomatériau de graphène. Selon les propriétés des nanomatériaux,ces interactions se manifesteront sous la forme d'associations spécifiques ou d'une combinaison de différentes associations, telles qu'un empilement hydrophobe π–π, une interaction électrostatique, une liaison hydrogène et une liaison covalente. Il est intéressant de noter que les associations graphène-biomolécule affecteront et modifieront de manière significative les propriétés physico-chimiques des nanomatériaux de graphène et leur donneront de nouvelles caractéristiques biologiques. En effet, ces événements seront décisifs pour influencer le devenir éventuel des nanomatériaux de graphène dans les systèmes physiologiques ainsi que les réponses biologiques ultérieures à leur égard.affectent et modifient de manière significative les propriétés physico-chimiques des nanomatériaux de graphène et leur confèrent de nouvelles caractéristiques biologiques. En effet, ces événements seront décisifs pour influencer le devenir éventuel des nanomatériaux de graphène dans les systèmes physiologiques ainsi que les réponses biologiques ultérieures à leur égard.affectent et modifient de manière significative les propriétés physico-chimiques des nanomatériaux de graphène et leur confèrent de nouvelles caractéristiques biologiques. En effet, ces événements seront décisifs pour influencer le devenir éventuel des nanomatériaux de graphène dans les systèmes physiologiques ainsi que les réponses biologiques ultérieures à leur égard.
Alors que les nanomatériaux de graphène se démarquent parmi le large éventail de nanomatériaux 2D 35 , 44 - 46 et ont été considérés comme très attractifs pour une pléthore d'applications biomédicales, les mécanismes fondamentaux à l'origine des associations graphène-protéine et les effets physiologiques des nanomatériaux de graphène sur les protéines, en particulier sur leur stabilité conformationnelle ainsi que sur leurs activités physiologiques, sont encore mal compris. Une compréhension globale de ces aspects est donc essentielle pour identifier les effets indésirables indésirables des nanomatériaux de graphène, établir les risques potentiels des nanomatériaux de graphène et, surtout, éviter leurs manifestations dans les systèmes biologiques. En effet, il a été démontré que les nanomatériaux de carbone déstabilisent et perturbent les conformations des protéines natives dans des conditions particulières, ce qui peut provoquer certains effets biologiques indésirables,telles que l'agrégation des protéines et l'augmentation de la génération d'espèces réactives de l'oxygène (ROS).
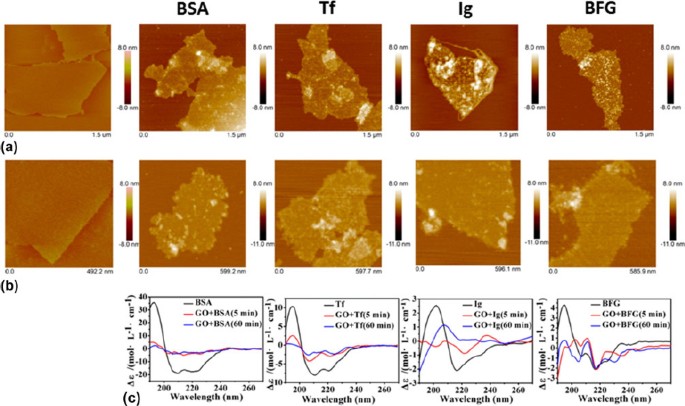
Il est encourageant de constater qu'un nombre croissant d'études visant à caractériser les interactions graphène-protéine ont été activement rapportées au cours des dernières années. 47 – 53 Par exemple, une étude récente a examiné l'adsorption des quatre protéines sériques les plus abondantes, à savoir l'albumine sérique bovine (BSA), la transferrine (Tf), l'immunoglobuline (Ig) et le fibrinogène bovin (BFG) sur deux nanomatériaux de graphène, c'est-à-dire les nanofeuillets GO et rGO (Fig. 3 ). 47 Il a été rapporté que ces protéines présentaient des comportements d'adsorption distincts sur les surfaces des nanofeuillets. BSA, par exemple, a formé des agrégats complexes lors de sa première interaction avec GO [Fig. 3(a)BSA]. De plus, ces agrégats s'étalent uniformément sur la surface de GO et présentent une variation négligeable au cours du temps [Fig. 3(b) BSA]. Cela a en outre été observé à partir des spectres de dichroïsme circulaire (CD) de BSA avant et après l'interaction avec GO. Plus clairement, le spectre CD de la BSA variait significativement après seulement une incubation de 5 minutes avec GO [Fig. 3(c) BSA]. La caractéristique -hélicoïdale de la BSA a diminué tandis que sa caractéristique de feuille s'est considérablement améliorée, suggérant que des agrégats riches en se sont formés sur la surface GO. Une incubation plus longue avec GO n'a pas fait varier le spectre CD de la BSA, ce qui implique que l'adsorption de la BSA a atteint un équilibre thermodynamique. Tf a également affiché un comportement d'adsorption similaire à celui de BSA [Figs. 3(a) et 3(b)Tf], avec une amélioration significative de la caractéristique de feuille , comme observé à partir des agrégats de Tf adsorbés sur la surface GO [Fig. 3(c) Vf]. Comme pour la BSA et la Tf, les molécules d'Ig et de BFG s'adsorbent et se répandent uniformément sur les surfaces GO lors de leurs interactions initiales [Fig. 3(a) Ig et BFG]. Cependant, au fil du temps, leur comportement d'adsorption uniforme s'est déplacé vers un comportement plus hétérogène [Fig. 3(b) Ig et BFG]. En fait, les spectres CD de l'Ig et du BFG variaient considérablement au cours du temps de 5 à 60 min, indiquant l'hétérogénéité structurelle sur les surfaces GO [Fig. 3(c)Ig et BFG]. Il a été observé que BSA et BFG avaient respectivement l'affinité de liaison la plus faible et la plus élevée avec GO. Les affinités de liaison des Ig et Tf avec GO, quant à elles, se situaient entre celles de BSA et BFG. La différence dans les comportements d'adsorption des protéines sériques sur les surfaces GO a été attribuée aux variations structurelles des protéines natives et à la prévalence des résidus exposés à la surface. De plus, la forte adsorption des protéines sériques sur la surface GO était entraînée par l'enthalpie via des interactions hydrophobes et essentiellement, de fortes interactions d'empilement π–π entre les résidus de protéines aromatiques et la surface GO. Surtout, cette étude a démontré que les quatre protéines sériques pouvaient s'adsorber sur la surface du nanomatériau de graphène de manière compétitive pour induire la formation de complexes de nanomatériau de graphène recouverts de protéines,ce qui pourrait modifier fondamentalement leurs voies d'interaction cellulaire et, surtout, diminuer leur cytotoxicité effective.
Interactions des nanofeuillets GO avec différentes protéines, c'est-à-dire BSA, Tf, Ig et BFG. (a, b) Morphologie de surface des nanofeuillets GO (première colonne) et différents complexes de protéines GO (colonnes suivantes) après incubation avec des nanofeuillets GO pendant (a) 5 min et (b) 60 min, tel qu'obtenu à l'aide d'un microscope à force atomique. (c) spectres CD des complexes GO-protéine correspondants. Adapté avec la permission de Réf. 47 . Copyright 2015 Société chimique américaine.
Séparément, il a été démontré que GO possède une capacité de charge élevée pour l'albumine et le fibrinogène dans un travail récent. 48 Il a été noté que les deux protéines plasmatiques s'adsorbaient bien sur la surface GO. Néanmoins, alors que la structure secondaire et la stabilité conformationnelle de l'albumine adsorbée étaient très peu perturbées lors de son interaction avec GO, celles du fibrinogène étaient significativement perturbées. Il est intéressant de noter que ces interactions entre les protéines plasmatiques et GO peuvent dépendre de manière significative de ses paramètres physico-chimiques, comme cela est de plus en plus rapporté. Par exemple, dans l'une des dernières études, les interactions entre les nanofeuillets GO avec différentes tailles latérales et distributions de tailles et trois protéines plasmatiques humaines essentielles, à savoir l'albumine, la globuline et le fibrinogène, ont été étudiées. 49 Il a été révélé que ces interactions nano-bio étaient spécifiques aux protéines et pourraient être considérablement influencées par la taille latérale moyenne et la distribution de taille des nanofeuillets GO. De plus, la chimie de surface des nanomatériaux de graphène peut être cruciale pour déterminer leur hémotoxicité et leur biocompatibilité. En tant que tel, il est prévu que les nanomatériaux de graphène avec différentes fonctionnalités de surface présenteront différents profils toxicologiques. Cela a été montré dans un rapport récent qui a étudié l'hémocompatibilité in vitro de GO modifié avec différentes fonctionnalités de surface, c'est-à-dire p-GO, GO-COOH et GO-PEI, avec la sérumalbumine humaine (HSA). 51 Il a été observé que p-GO et GO-PEI induisaient une toxicité significative sur la HSA lors de leurs interactions, tandis que la HSA présentait un changement de conformation négligeable lors de la liaison avec GO-COOH.
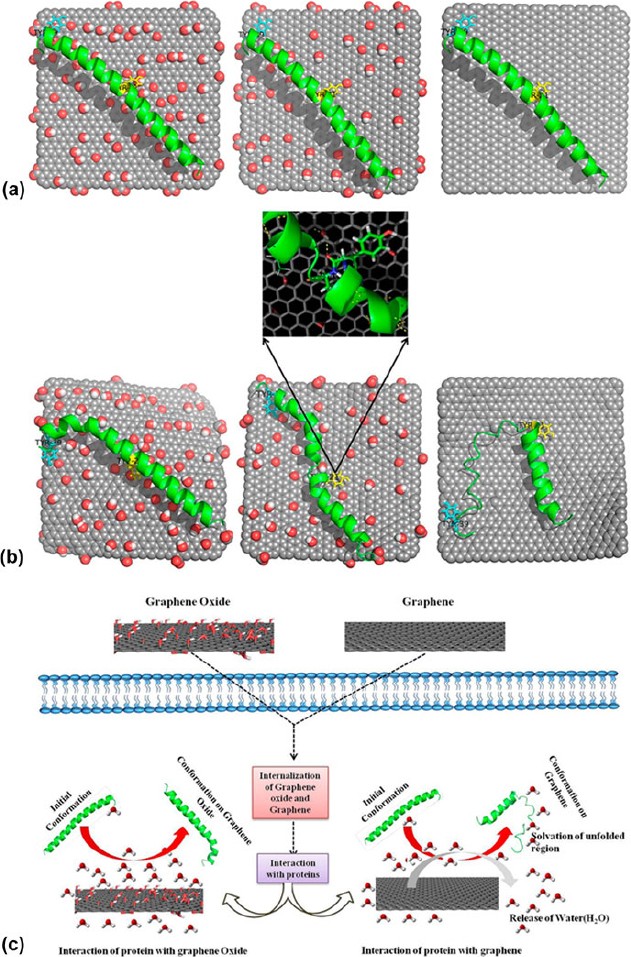
Alors que de nombreuses études ont rapporté des observations sur le changement de conformation des protéines induit par les nanomatériaux de graphène, les mécanismes sous-jacents sont encore mal compris et loin d'être établis. À l'aide de simulations de dynamique moléculaire, une étude récente a tenté d'examiner l'influence du graphène et de ses deux dérivés, à savoir GO et rGO, sur la structure conformationnelle de la protéine cytoplasmique lors de son adsorption sur la surface du nanomatériau de graphène ainsi que les mécanismes moléculaires sous-jacents (Fig. 4 ). 52 Dans l'étude, la région -hélicoïdale de la protéine cytoplasmique chargée positivement a été choisie comme site modèle spécifique pour l'enquête. Dans le microenvironnement physiologique, la partie -hélicoïdale de la protéine interagit généralement avec son récepteur naturel, c'est-à-dire le récepteur de la protéine d'attachement soluble (SNARE). GO possédait une surface de 25 nm 2et des groupes hydroxyle et époxy décorés de manière aléatoire sur sa surface. De plus, un groupe carboxyle était attaché aux bords GO. Tout en ayant la même surface, par rapport à GO, le modèle rGO possède moins de groupes fonctionnels oxygénés. En fait, le rapport oxygène (O)-carbone (C) dans rGO et GO était d'environ 1 à 20 et 1 à 5, respectivement. Pour tous les systèmes, la protéine a été initialement placée dans une configuration diagonale, séparée de la surface du nanomatériau de graphène par une distance de 10,5 Å [Fig. 4(a) ].
Etude par simulation de dynamique moléculaire de l'adsorption de protéines sur des nanomatériaux de graphène. (a) Les conformations initiales et (b) finales de différents complexes nanomatériau-protéine de graphène : GO-protéine (à gauche), rGO (au centre) et graphène-protéine (à droite). L'oxygène, l'hydrogène et le carbone sont respectivement surlignés en rouge, blanc et gris. Le jaune et le cyan représentent respectivement Tyr 21 et Tyr 39. (c) Illustration schématique montrant les mécanismes proposés d'adsorption des protéines sur GO et le graphène. Adapté avec la permission de Réf. 52 . Copyright 2013 Société chimique américaine.
Sur ses interactions avec différents nanomatériaux de graphène, la protéine a affiché des comportements d'adsorption uniques sur GO, rGO et graphène. La protéine présentait la conformation la plus stable lorsqu'elle s'adsorbait sur GO, suivie par rGO et graphène [Fig. 4(b)]. En fait, la protéine a conservé sa conformation -hélicoïdale sur la surface GO lors de l'adsorption. Pour la protéine adsorbée sur la surface GO, il a en outre été révélé que, bien que certaines variations mineures se soient produites à l'extrémité C-terminale, la plupart de ses résidus d'acides aminés conservaient toujours leur conformation d'origine. Pendant ce temps, pour la protéine adsorbée sur rGO, des transitions α à tour dans les régions médiane et C-terminale ont été observées. En revanche, la conformation de la plupart des résidus d'acides aminés n'a pas été préservée pour la protéine adsorbée sur le graphène, et ces résidus d'acides aminés ont également connu α pour tourner et 3 10transitions hélicoïdales. L'analyse de la structure secondaire de la protéine a révélé que la grande stabilité de la conformation de la protéine sur GO pourrait être due à l'hydratation importante à la surface de GO ainsi qu'à l'absence d'implication des résidus tyrosine dans les interactions d'empilement π–π avec GO . En fait, parmi les différents résidus d'acides aminés, seuls les résidus aromatiques (c'est-à-dire Tyr) et chargés positivement (c'est-à-dire Arg et Lys) interagissaient sélectivement avec GO via une liaison hydrogène. En outre, il a été noté que l'empilement π–π des résidus de tyrosine, en particulier Tyr 21 et Tyr 39, diminuait avec une augmentation de la quantité de groupes fonctionnels sur les surfaces des nanomatériaux de graphène. De façon intéressante,la nature de l'interaction protéine-GO ressemblait à celle formée entre la protéine et son SNARE car la surface GO était capable d'accepter des liaisons hydrogène similaires au récepteur naturel de la protéine existant généralement dans un environnement physiologique. Finalement, il a été proposé que les interactions électrostatiques étaient les principales forces motrices derrière l'adsorption hautement sélective de protéines sur GO tandis que l'adsorption de protéines sur rGO et graphène était médiée par les interactions d'empilement de van der Waals et π–π [Fig.il a été proposé que les interactions électrostatiques étaient les principales forces motrices de l'adsorption hautement sélective des protéines sur GO tandis que l'adsorption des protéines sur rGO et le graphène était médiée par les interactions d'empilement de van der Waals et π–π [Fig.il a été proposé que les interactions électrostatiques étaient les principales forces motrices de l'adsorption hautement sélective des protéines sur GO tandis que l'adsorption des protéines sur rGO et le graphène était médiée par les interactions d'empilement de van der Waals et π–π [Fig.4(c) ]. En fin de compte, cette étude a montré que la différence dans les chimies de surface des nanomatériaux de graphène pourrait influencer de manière significative les modèles d'adsorption et la stabilité conformationnelle des biomolécules.
De même, à l'aide de simulations dynamiques moléculaires approfondies de tous les atomes, une étude distincte visait à démêler les mécanismes moléculaires sous-jacents à l'adsorption des protéines sanguines à la surface du graphène dans la formation de complexes de nanomatériaux de graphène recouverts de protéines. 53 Cette étude a mis en évidence le rôle important des résidus aromatiques dans le processus d'adsorption, en particulier à travers leurs cycles aromatiques pour faciliter les fortes interactions d'empilement π–π avec le graphène sp 2-carbones. Curieusement, on a observé que des résidus basiques, tels que l'arginine, jouaient un rôle tout aussi crucial ou plus important dans ce processus d'adsorption, conduisant à la formation de complexes protéine-graphène. Il a été suggéré que la liaison étroite des résidus basiques à la surface du graphène était due à de fortes interactions de dispersion formées entre la surface du nanomatériau et les chaînes latérales des résidus basiques.
En plus des effets biologiques sur les protéines plasmatiques individuelles, l'hémocompatibilité moléculaire des nanomatériaux de graphène est également généralement évaluée en fonction de leur activité anticoagulante, caractérisée par des facteurs de temps de coagulation du plasma. Ce sont des mesures normalement utilisées pour évaluer les voies de coagulation du plasma. La cascade de coagulation plasmatique se compose généralement de deux voies différentes, c'est-à-dire des voies extrinsèques et intrinsèques, qui convergent pour transformer la prothrombine en thrombine afin d'activer la conversion du fibrinogène en fibrine pour la génération de caillots sanguins. En tant que tels, les facteurs de temps de coagulation plasmatique sont normalement classés en temps de Quick (TP) et en temps de céphaline activée (TCA), qui évaluent les anomalies des facteurs impliqués dans les voies de coagulation extrinsèque et intrinsèque, respectivement.
Dans l'un des rapports récents, l'activité anticoagulante des nanomatériaux de graphène vierges et fonctionnalisés, en particulier leur effet biologique sur les voies intrinsèques et extrinsèques de la coagulation du plasma, a été évaluée. 54 Il a été rapporté qu'en présence de graphène vierge et fonctionnalisé avec des concentrations allant jusqu'à 75 g/mL, toutes les valeurs aPTT et PT se situaient dans les plages normales standard. Cela suggère que les deux nanomatériaux de graphène n'ont pas affecté les deux voies de coagulation du plasma. Dans une étude distincte, le graphène chimiquement réduit a été modifié de manière non covalente avec de l'héparine non fractionnée (UFH) et l'activité anticoagulante du conjugué a ensuite été examinée. L'héparine est un glycosaminoglycane anionique largement connu pour son effet anticoagulant et, par conséquent, l'héparinisation directe des nanomatériaux devrait améliorer leur hémocompatibilité. Fait intéressant, le conjugué graphène/UFH présentait une activité antifacteur Xa (FXa) et une compatibilité sanguine globale significativement améliorées par rapport au GO vierge. De même, à base d'héparine,une autre enquête a démontré la synthèse de rGO fonctionnalisé avec une stabilité améliorée en solution aqueuse et une excellente activité anticoagulante et biocompatibilité. Dans l'étude, l'héparine a agi à la fois comme agent réducteur et comme stabilisant efficace. Plus clairement, l'incorporation d'héparine a induit l'élimination de certaines fonctionnalités oxygénées de GO, conduisant à la génération de rGO. L'héparine a ensuite été fonctionnalisée sur rGO via des liaisons hydrogène et des interactions hydrophobes. Après sa préparation, l'activité anticoagulante de la rGO fonctionnalisée par l'héparine (héparine-rGO) a été évaluée sur la base des tests aPTT et PT. Il a été observé que l'aPTT et le PT étaient prolongés en présence d'héparine-rGO, suggérant que l'héparine-rGO était capable d'inhiber à la fois les voies intrinsèques et extrinsèques de la coagulation sanguine. Fait intéressant, en tant que contrôle,l'activité anticoagulante de la GO et de l'hydrazine-rGO a également été examinée. Il a été noté que GO et hydrazine-rGO étaient capables de prolonger l'aPTT mais pas le PT, indiquant que seule la voie intrinsèque de la coagulation pouvait être inhibée par ces deux nanomatériaux de graphène. De plus, la prolongation de l'aPTT par GO et hydrazine-rGO était considérablement plus faible que celle de l'héparine-rGO, ce qui implique que l'héparine-rGO possédait un excellent comportement anticoagulant, et différentes voies de coagulation inhibitrices pourraient être réalisées avec l'utilisation de nanomatériaux de graphène avec différentes fonctionnalités de surface.la prolongation de l'aPTT par GO et hydrazine-rGO était considérablement plus faible que celle de l'héparine-rGO, ce qui implique que l'héparine-rGO possédait un excellent comportement anticoagulant, et différentes voies de coagulation inhibitrices pourraient être réalisées avec l'utilisation de nanomatériaux de graphène avec différentes fonctionnalités de surface.la prolongation de l'aPTT par GO et hydrazine-rGO était considérablement plus faible que celle de l'héparine-rGO, ce qui implique que l'héparine-rGO possédait un excellent comportement anticoagulant, et différentes voies de coagulation inhibitrices pourraient être réalisées avec l'utilisation de nanomatériaux de graphène avec différentes fonctionnalités de surface.
IV. INTERACTIONS DES NANOMATÉRIAUX DE GRAPHÈNE AVEC LES GLOBULES SANGUINS PÉRIPHÉRIQUES
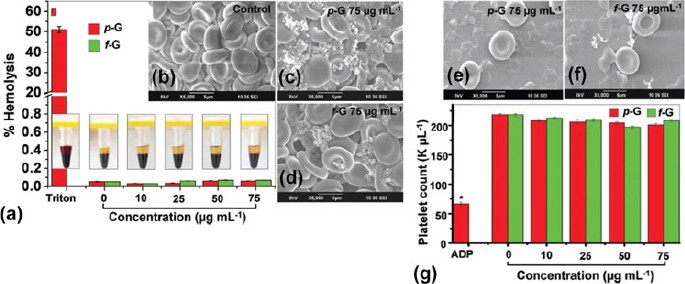
L'hémocompatibilité cellulaire des nanomatériaux de graphène peut être évaluée sur la base de nombreux paramètres, tels que l'activation plaquettaire, l'agrégation plaquettaire et l'hémolyse ou la libération d'hémoglobine lors de la rupture de la membrane RBC. Par exemple, les interactions in vitro entre deux nanomatériaux de graphène différents et le sang périphérique humain ont été évaluées récemment (Fig. 5 ). 54 Par la suite, la thrombogénicité et la compatibilité sanguine de ces nanomatériaux de graphène ont été déduites. Il a été observé que jusqu'à une dose de 75 g/mL, le graphène vierge hydrophobe et le graphène fonctionnalisé hydrophile n'ont pas provoqué d'hémolyse [Fig. 5(a) ]. La caractérisation morphologique des globules rouges incubés avec contrôle négatif [Fig. 5(b)], 75 g/mL de graphène vierge [Fig. 5(c) ], et 75 g/mL de graphène fonctionnalisé [Fig. 5(d) ] a en outre confirmé la biocompatibilité des nanomatériaux de graphène avec les globules rouges. Il était clair que l'intégrité de la membrane des globules rouges vierges et fonctionnalisés traités au graphène était très peu perturbée, et ils maintenaient toujours leur morphologie biconcave similaire à celle des globules rouges non traités. Curieusement, il a également été remarqué que jusqu'à une dose de 75 g/mL, les deux nanomatériaux de graphène n'induisaient pas l'activation des plaquettes. De plus, la morphologie colloïdale de ces plaquettes était encore conservée en présence de nanomatériaux de graphène [Figs. 5(e) et 5(f) ]. Fait intéressant, ces plaquettes traitées au graphène ont également conservé une numération normale [Fig.5(g) ], ce qui implique que l'agrégation plaquettaire n'a pas été déclenchée par les deux systèmes de graphène.
Compatibilité sanguine de différents nanomatériaux de graphène. (a) Évaluation de l'hémolyse du sang total traité avec des nanomatériaux de graphène vierges et fonctionnalisés avec différentes concentrations allant de 0 à 75 g/mL. (b–d) Morphologie des globules rouges traités avec : (b) un contrôle négatif, (c) du graphène vierge et (d) du graphène fonctionnalisé. Les deux nanomatériaux de graphène ont été fixés à 75 μg/mL. (e, f) Morphologie des plaquettes traitées avec : (e) du graphène vierge et (f) du graphène fonctionnalisé. Les deux nanomatériaux de graphène ont été fixés à 75 μg/mL. (g) Analyse de la numération plaquettaire du sang total traité avec des nanomatériaux de graphène vierges et fonctionnalisés avec différentes concentrations allant de 0 à 75 g/mL. Adapté avec la permission de Réf. 54 . Copyright 2012 Wiley-VERLAG GmbH & Co.
Dans une étude plus récente, l'effet hématologique in vitro des nanoplaquettes de graphène fonctionnalisées au dextrane (GNP-Dex) sur l'activation plaquettaire et l'hémolyse des cellules sanguines a été évalué. 55 L'étude a révélé qu'après avoir traité du sang total humain avec du GNP-Dex, ni l'activation plaquettaire in vitro ni l'hémolyse des cellules sanguines dans le sang total humain n'étaient induites, démontrant l'hémocompatibilité du complexe GNP-Dex. Séparément, les effets hématologiques in vitro d'autres nanomatériaux de graphène modifiés ont été examinés grâce à une évaluation systématique de leur potentiel anticoagulant. 56 Ici, le graphène a été implanté avec COOH +ions pour générer un complexe COOH-graphène avec des propriétés anticoagulantes améliorées. De manière encourageante, il a été observé que le complexe COOH-graphène n'a causé aucune toxicité sur les globules rouges et les plaquettes. Il a en outre été démontré que dans les mêmes conditions, par rapport au graphène vierge, le graphène implanté dans COOH induisait une activation, une adhésion et une agrégation plaquettaires significativement plus faibles. Il a été suggéré que l'amélioration considérable de la propriété anticoagulante du complexe COOH-graphene était influencée par la quantité de groupes carboxyle possédés par le graphène modifié. En outre, le graphène a été modifié avec une amine (G-NH 2 ) et signalé comme hautement hémocompatible. 57 Il a été démontré que le G-NH 2 chargé positivementn'a pas induit d'hémolyse et n'a montré aucun effet stimulant sur les plaquettes. De plus, après injection intraveineuse chez la souris, le G-NH 2 n'a pas provoqué de thromboembolie pulmonaire.
En plus de celle du graphène vierge et fonctionnalisé, l'hémocompatibilité cellulaire d'autres nanomatériaux à base de graphène a été de plus en plus caractérisée. Par exemple, il a été rapporté que les nanofeuillets GO possèdent un fort potentiel d'induction de thrombus et une thrombogénicité considérable. 58 Ils pourraient également déclencher l'activation des plaquettes et leur forte réponse agrégative similaire à celle évoquée par la thrombine, un agoniste plaquettaire physiologique actif. Il a été suggéré que l'activation des plaquettes par GO dépendait largement de la distribution de charge de surface de GO car il a été révélé que, contrairement à GO, rGO avec une densité de charge de surface réduite était moins capable d'activer et d'agréger les plaquettes. La caractéristique prothrombotique des nanofeuillets GO a été en outre vérifiée par la survenue d'une thromboembolie pulmonaire significative après leur administration intraveineuse chez la souris. Séparément, l'hémocompatibilité des feuilles de graphène et de GO avec différentes tailles, degrés d'exfoliation et teneur en oxygène sur les globules rouges a également été évaluée. 36 Il a été noté que les feuilles de graphène et de GO provoquent une hémolyse dose-dépendante. En fait, l'étendue de l'hémolyse des globules rouges était fortement influencée par la taille des nanomatériaux de graphène et le degré de leur exfoliation. Plus clairement, les plus petites feuilles de GO soniquées présentaient un effet hémolytique plus prononcé par rapport aux plus grandes feuilles de GO non traitées. En outre, un effet hémolytique plus élevé a été noté à partir des feuilles de GO bien dispersées avec une densité d'oxygène de surface plus élevée par rapport aux feuilles de graphène agrégées. L'activité hémolytique des feuilles GO, cependant, pourrait être considérablement réduite en les enrobant de chitosane. Essentiellement, cette étude a mis en évidence le fort impact des propriétés physico-chimiques des nanomatériaux de graphène, telles que la taille physique et la teneur en oxygène/charge de surface, sur leurs effets biologiques et toxicologiques sur les globules rouges. Dans un autre rapport,les cellules mononucléées du sang périphérique ont été traitées avec des nanomatériaux GO, qui possédaient des dimensions différentes et étaient dispersés dans différentes solutions aqueuses, c'est-à-dire GO avec des dimensions d'environ 100 nm et plus de 2 m dispersés dans l'eau ainsi que GO avec une dimension d'environ 100 nm dispersé dans une solution saline tamponnée au phosphate. 59 Il a été rapporté qu'après 24 h, aucun effet biologique indésirable n'a été détecté sur ces cellules sanguines traitées par GO.
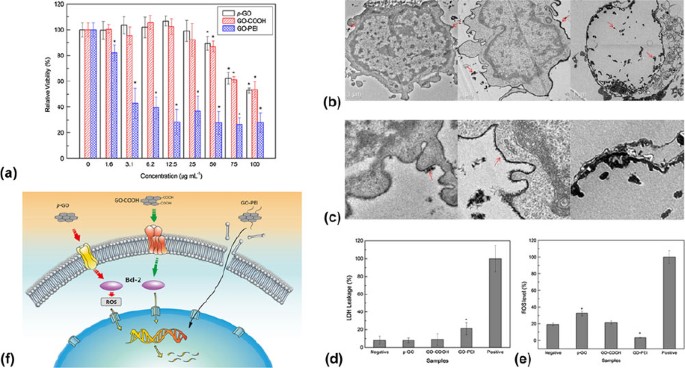
En plus des globules rouges et des plaquettes, une étude récente a évalué l'hémotoxicité in vitro de divers nanomatériaux GO sur les lymphocytes T du sang périphérique humain (Fig. 6 ). 51 Possédant un rôle essentiel dans le système immunitaire, les lymphocytes T sanguins sont un type spécifique de globules blancs qui maintiennent généralement un état de repos non prolifératif. Une déficience ou une activation induite des lymphocytes T peut entraîner des problèmes de santé et des maladies indésirables, telles que les maladies auto-immunes et le cancer. Dans l'étude, trois nanomatériaux GO différents, c'est-à-dire le GO vierge (p-GO) et le GO modifié avec deux fonctionnalités de surface distinctes (GO-COOH et GO-PEI), ont été utilisés. La cytotoxicité des nanomatériaux GO a d'abord été évaluée après leur exposition, à des concentrations variant de 0 à 100 µg/mL, aux lymphocytes T pendant 24 h [Fig. 6(a)]. Le p-GO s'est avéré hautement hémocompatible et a induit une cytotoxicité négligeable à des concentrations inférieures à 25 g/mL. Néanmoins, la viabilité relative des lymphocytes T a commencé à diminuer lorsque la concentration de p-GO a augmenté au-delà de 50 g/mL. Semblable à p-GO, GO-COOH a présenté un effet cytotoxique dose-dépendant sur les lymphocytes T. En revanche, avec une concentration croissante de GO-PEI, les lymphocytes T traités par GO-PEI présentaient une réduction correspondante de leur viabilité. En fait, GO-PEI a provoqué une cytotoxicité significative même à une faible concentration de 1,6 g/mL. Cela pourrait être attribué à la teneur élevée en PEI conjugué dans le complexe GO-PEI. Il est intéressant de noter que la structure continue de la membrane cellulaire des lymphocytes T traités par p-GO et GO-COOH a été observée comme étant minimalement compromise et est restée intacte [Fig. 6(b)]. De plus, il n'y avait aucune trace de p-GO et GO-COOH détectée dans le cytoplasme et le noyau des lymphocytes T, et seule une petite quantité d'agrégats p-GO et GO-COOH s'adsorbait sur la membrane cellulaire [Fig. 6(c)]. Cela suggère en outre que p-GO et GO-COOH n'ont pas endommagé la membrane cellulaire lors de leur liaison avec les lymphocytes T, et il était très probable que les deux nanomatériaux GO n'aient pas été internalisés dans le cytoplasme. En revanche, de grandes zones creuses dues à la décharge de cytoplasme et de matériaux endonucléaires ont été observées à partir des lymphocytes T traités par GO-PEI. Un examen supplémentaire a révélé la structure de la membrane cellulaire discontinue de ces cellules traitées par GO-PEI et la localisation de GO-PEI dans le noyau, ce qui implique que GO-PEI pourrait induire une cytotoxicité sur les lymphocytes T via les dommages de la membrane cellulaire induits par l'interaction physique.
Hémotoxicité des nanomatériaux GO sur les lymphocytes T du sang périphérique. (a) Viabilité cellulaire relative des lymphocytes T après une incubation avec divers nanomatériaux GO avec différentes concentrations pendant 24 h. (b) Images de microscopie électronique à transmission (MET) des lymphocytes T sectionnés traités avec p-GO (à gauche), GO-COOH (au centre) et GO-PEI (à droite) à une concentration de 100 g/mL. (c) Images MET agrandies de (b). Les flèches rouges indiquent les agrégats GO. (d) Intégrité de la membrane plasmique des lymphocytes T évaluée à l'aide d'un test de fuite de LDH après une incubation de 24 h avec GO à une concentration de 100 g/mL. (e) Niveau de ROS des lymphocytes T évalué à l'aide du dosage DCFH-DA après une incubation avec GO à une concentration de 100 g/mL. *Indique une différence statistiquement significative par rapport au contrôle pour P< 0,05. (f) Illustration schématique montrant les mécanismes proposés sous-jacents à l'hémotoxicité de différents nanomatériaux GO sur les lymphocytes T du sang périphérique. Adapté avec la permission de Réf. 51 . Copyright 2014 Société chimique américaine.
L'intégrité de la membrane des lymphocytes T traités par le nanomatériau GO a été examinée plus avant à l'aide d'un test de libération de lactate déshydrogénase (LDH) [Fig. 6(d)]. Aucune fuite considérable de LDH n'a été observée à partir des lymphocytes T traités par p-GO et GO-COOH, indiquant que ces nanomatériaux GO ne compromettaient pas physiquement l'intégrité de la membrane plasmique bien qu'ils présentaient une cytotoxicité significative à des concentrations élevées. Comparativement, les lymphocytes T traités par GO-PEI présentaient une fuite de LDH significative, confirmant davantage la cytotoxicité de GO-PEI basée sur les dommages à la membrane cellulaire. Curieusement, en plus des dommages à la membrane cellulaire, le stress oxydatif dû à une augmentation de la génération de ROS a également été émis comme un autre mécanisme possible sous-jacent à la cytotoxicité des nanomatériaux GO. En tant que tel, la réponse au stress oxydatif des lymphocytes T traités par le nanomatériau GO a ensuite été évaluée à l'aide d'un dosage de diacétate de 2,7-dichlorofluorescéine (DCFH-DA) basé sur la fluorescence [Fig. 6(e)]. Une génération accrue de ROS intracellulaires a été notée à partir des lymphocytes T traités par p-GO, tandis que les cellules traitées par GO-COOH présentaient un niveau de ROS intracellulaire normal. En revanche, un faible signal de fluorescence a été détecté à partir des cellules traitées au GO-PEI car leur membrane plasmique était endommagée, entraînant la décharge de leurs produits fluorescents. Alors que l'adsorption de pGO sur la membrane cellulaire ne l'a pas endommagé physiquement ni n'a provoqué l'internalisation de pGO dans la cellule, les interactions lymphocytaires pGO-T ont entraîné une augmentation du niveau de ROS, des dommages à l'ADN intranucléaire et une apoptose cellulaire [Fig. 6(f)]. Cependant, avec son potentiel d'induction de l'apoptose, pGO n'a étonnamment pas supprimé la réponse immunitaire des lymphocytes T. Comme la pGO possédait une capacité de liaison aux protéines, il a été proposé que la cytotoxicité de la pGO pourrait provenir de ses interactions directes avec les récepteurs protéiques membranaires, tels que TCR et CKR, ainsi que de son inhibition de la capacité de liaison récepteur-ligand protéique, résultant en l'apparition d'une apoptose passive induisant une fracture de l'ADN, dépendante des ROS, via la voie du lymphome à cellules B-2 (Bcl-2). Semblable à pGO, GO-COOH a provoqué un effet cytotoxique comparable sur les lymphocytes T. Cependant, un niveau de ROS normal a été maintenu, indiquant que l'inhibition de la liaison récepteur-ligand de la protéine membranaire et la transduction du signal d'apoptose passive à l'ADN du noyau ont été effectuées via une voie indépendante des ROS. GO-PEI, en revanche,a évoqué une hémotoxicité significative sur les lymphocytes T en endommageant physiquement la membrane plasmique.
Alors qu'un grand nombre d'études sur l'hémocompatibilité moléculaire et cellulaire des nanomatériaux de graphène ont été menées au cours des dernières années, la majorité de ces études ont été réalisées dans un environnement statique in vitro. Cependant, l'analyse et les conclusions obtenues dans des conditions statiques in vitro peuvent ne pas pouvoir être traduites directement pour déduire les propriétés hémotologiques des nanomatériaux de graphène dans des environnements dynamiques in vivo. Par conséquent, pour évaluer les impacts hématologiques réels des nanomatériaux de graphène, davantage de tests devraient être effectués dans des conditions in vivo. Les tests in vivo présentent néanmoins un certain niveau de défis techniques. Par conséquent, ces dernières années ont vu l'émergence de la technologie microfluidique pour la recherche vasculaire et la thrombose.En effet, les dispositifs microfluidiques permettent de mener des expériences dans un environnement in vitro tridimensionnel contrôlé, imitant l'environnement physiologique dynamique in vivo.60 – 65 Par conséquent, en plus des effets biologiques et de la toxicité des nanomatériaux de graphène sur les protéines plasmatiques et les cellules sanguines individuelles dans des conditions in vitro statiques, l'hémocompatibilité des nanomatériaux de graphène a été évaluée sur du sang total dans des conditions d'imitation actives in vivo.
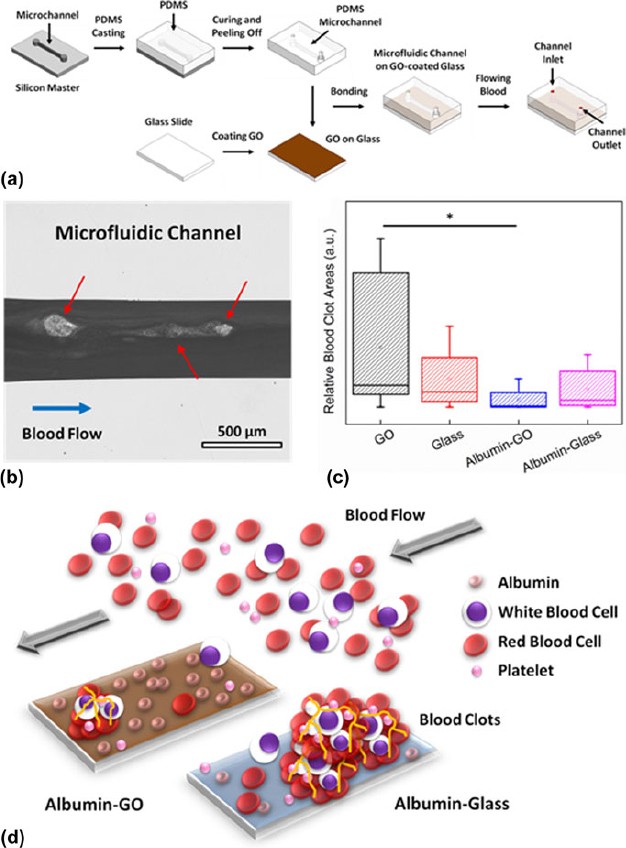
Dans l'une des dernières études, l'effet de la GO vierge et de la GO fonctionnalisée à l'albumine (albumine-GO) sur le sang total humain a été évalué dans des conditions de flux dynamique à l'aide de canaux microfluidiques imitant les vaisseaux microvasculaires (Fig. 7 ). 48 Dans l'étude, des dispositifs microfluidiques avec quatre matériaux de base différents, c'est-à-dire GO, albumine-GO, verre (témoin non revêtu) et verre à albumine (témoin revêtu), ont été fabriqués sur la base des techniques de lithographie douce standard [Fig. 7(a) ]. Le potentiel d'induction de caillots sanguins des nanomatériaux GO a été examiné à travers la formation de caillots sanguins dans les microcanaux sous un débit sanguin de 10 L/min pendant 20 min [Fig. 7(b)]. La formation de caillots sanguins en présence de biomatériaux synthétiques est en effet l'une des métriques in vitro les plus utilisées pour évaluer leur hémocompatibilité. Fait intéressant, il a été observé que le microcanal recouvert de GO provoquait la formation de la plus grande quantité de caillots sanguins tandis que la plus faible quantité de caillots sanguins était formée dans le microcanal recouvert d'albumine GO [Fig. 7(c)]. Il a été suggéré que la quantité plus élevée de caillots sanguins formés dans le microcanal recouvert de GO était due à l'existence de la densité plus élevée de groupes fonctionnels oxygénés et de la charge de surface sur GO. Cela pourrait, en fait, conduire à une charge de fibrinogène plus élevée sur la surface GO, entraînant la formation de fibrine et de caillots de fibrine, ce qui facilitait l'adhésion et l'agrégation plaquettaires ainsi que la génération ultérieure de caillots sanguins. En revanche, il a été proposé que la forte adsorption et la capacité de charge élevée de l'albumine sur GO soient les mécanismes sous-jacents alimentant la formation de la plus faible quantité de caillots sanguins dans le microcanal recouvert d'albumine-GO. Plus clairement, avec une forte adsorption d'albumine, la surface GO était considérablement passive de la liaison non spécifique avec diverses biomolécules favorisant la formation de caillots sanguins,conduisant à une formation minimale de caillots sanguins activés par contact et à l'apparition d'une thrombose [Fig.7(d) ]. Par conséquent, la propriété antithrombotique améliorée du GO fonctionnalisé à l'albumine sous flux sanguin dynamique ainsi que son application potentielle pour le revêtement antithrombotique des dispositifs biomédicaux en contact avec le sang ont été mises en évidence dans cette étude. Essentiellement, il a démontré que l'hémocompatibilité des nanomatériaux GO sous flux sanguin dynamique pouvait être ajustée via une fonctionnalisation de surface appropriée.
Potentiel d'induction de caillots sanguins de GO sous flux dynamique. (a) Illustration schématique montrant la fabrication du canal microfluidique recouvert de GO pour l'évaluation du potentiel d'induction de caillots sanguins de GO vierge et fonctionnalisé. (b) Micrographie optique montrant la formation de caillots sanguins dans un canal microfluidique. La barre d'échelle représente 500 um. (c) Zones relatives de caillots sanguins formées dans les microcanaux avec différents matériaux de base : GO, verre, albumine-GO et albumine-verre. *Indique une différence statistiquement significative pour P < 0,05 sur la base du test t bilatéral de Student. (d) Illustration schématique montrant le faible potentiel d'induction de caillots sanguins de la GO fonctionnalisée à l'albumine. Adapté avec la permission de Réf. 48. Copyright 2015 Wiley-VERLAG GmbH & Co.
V. RÉSUMÉ ET PERSPECTIVES
Au cours de la dernière décennie, les nanomatériaux de graphène sont devenus l'un des nanomatériaux 2D les plus prometteurs avec un potentiel passionnant pour un large éventail d'applications biologiques et biomédicales. Des recherches actives et des explorations scientifiques au cours des dernières années ont révélé les caractéristiques structurelles uniques et un assortiment de propriétés physico-chimiques remarquables des nanomatériaux de graphène, ainsi que leurs applications potentielles dans divers domaines de la bionanotechnologie et de la nanomédecine.
Bien que des avancées prometteuses dans des domaines pertinents aient été activement démontrées, il est clair qu'à ce jour, la majorité des applications biomédicales signalées des nanomatériaux de graphène en sont encore à leurs balbutiements. En fait, la traduction de ces démonstrations de preuve de concept en applications pratiques et cliniques en est encore à ses débuts en raison des nombreuses questions sans réponse et des défis non résolus. Des efforts considérables sont donc nécessaires pour répondre à ces préoccupations afin de réaliser les bioapplications pratiques des nanomatériaux de graphène. L'une des préoccupations les plus fondamentales concernant les bioapplications pratiques des nanomatériaux de graphène est leur hémotoxicité. Les nanomatériaux de graphène, d'une épaisseur allant d'une à quelques couches atomiques, devraient présenter des interactions uniques avec des entités hématologiques, soulevant des questions critiques sur leurs effets hématologiques. En tant que tel, la caractérisation complète et l'élucidation de leurs interactions moléculaires et cellulaires avec les composants sanguins individuels dans le système circulatoire sanguin, notamment les protéines plasmatiques, les plaquettes, les globules rouges et les globules blancs, sont essentielles. De plus, des évaluations approfondies des effets hématologiques in vitro et in vivo des nanomatériaux de graphène, en particulier les effets de leurs propriétés physico-chimiques sur leur hémocompatibilité, sont cruciales pour permettre la conception et l'ingénierie sûres de nanomatériaux de graphène fonctionnels avec une hémotoxicité minimale et les globules blancs, sont essentiels.
Bien que développer une compréhension approfondie des interactions graphène-sang ne soit pas anodin mais très difficile, on peut éventuellement s'inspirer des biotechniques émergentes pour obtenir de l'aide. Par exemple, pour élucider davantage les interactions moléculaires entre les nanomatériaux de graphène et les protéines du plasma sanguin, on peut probablement se tourner vers la technologie évolutive d'affichage sur phage. 66 – 69 Grâce à cet essai, de courts motifs peptidiques possédant une affinité accrue et une liaison sélective aux nanomatériaux de graphène peuvent être découverts et identifiés. En fait, des peptides capables de se lier préférentiellement aux bords ou au plan basal des nanomatériaux de graphène ont récemment été identifiés grâce à l'analyse par phage-display. 66 , 67 Couplé à d'autres techniques, telles que les simulations de dynamique moléculaire atomistique, les structures et séquences précises des protéines plasmatiques adsorbées ainsi que les mécanismes et la dynamique des interactions entre les nanomatériaux de graphène et les protéines plasmatiques peuvent être davantage déterminés. 70
Il est intéressant de noter que, alors que les évaluations du profil hémotoxicologique des nanomatériaux de graphène ont commencé à prendre de l'ampleur il y a seulement plusieurs années, des résultats contradictoires ont été démontrés. Ces contradictions apparentes peuvent provenir de variations dans la synthèse et le traitement des nanomatériaux de graphène, produisant des nanomatériaux de graphène avec un large éventail de caractéristiques morphologiques et physico-chimiques. La taille physique et la distribution des tailles, la forme, le nombre de couches, la pureté, le niveau d'oxydation et la fonctionnalité de surface des nanomatériaux de graphène sont quelques-uns des paramètres physico-chimiques qui diffèrent d'une étude à l'autre, ce qui rend extrêmement difficile de tirer des conclusions substantielles à partir des sources disponibles. . Étant donné que de nombreuses enquêtes ne sont pas directement comparables, il existe un besoin urgent de protocoles standardisés et d'approches systématiques pour évaluer le profil hémotoxicologique des nanomatériaux de graphène. Néanmoins, cela a été largement entravé par le manque de manipulation précise sur les caractéristiques morphologiques et les dimensions physiques des nanomatériaux de graphène. Par conséquent, des améliorations majeures dans ce domaine sont essentielles pour réaliser des percées significatives. Par ailleurs, de nombreuses évaluations d'hémocompatibilité et d'hémotoxicité ont été réalisées sur une courte période. Les effets hématologiques à long terme des nanomatériaux de graphène, en fait, sont encore largement inconnus ou mal compris. Par conséquent, il est important de caractériser les risques hématologiques à long terme des nanomatériaux de graphène pour démêler le sort ultime des nanomatériaux de graphène dans les corps vivants.
À l'avenir, des progrès progressifs et soutenus dans divers domaines sont attendus. Ceux-ci incluent la synthèse contrôlée, le traitement et la caractérisation des nanomatériaux de graphène, ainsi que l'examen des associations graphène-sang. En fait, des intégrations plus synergiques d'approches théoriques, expérimentales et de simulation devraient repousser les limites de nos connaissances actuelles sur la relation entre les nanomatériaux de graphène et diverses entités hématologiques dans le système circulatoire. Une compréhension plus approfondie de l'hémocompatibilité et de l'hémotoxicité des nanomatériaux de graphène peut donc être obtenue. Surtout, la traduction des démonstrations de preuve de concept en applications pratiques et cliniques ne sera plus insurmontable, et des percées transformatrices dans les applications biologiques et biomédicales des nanomatériaux de graphène pourraient être réalisées dans un avenir proche.
Aucun commentaire:
Enregistrer un commentaire
Les commentaires hors sujet, ou comportant des attaques personnelles ou des insultes seront supprimés. Les auteurs des écrits publiés en sont les seuls responsables. Leur contenu n'engage pas la responsabilité de ce blog ou de Hannibal Genséric. Les commentaires sont vérifiés avant publication, laquelle est différée de quelques heures.